Física Entretenida
Los temas de Física y Fisicoquímica de la Secundaria en la Pcia de Buenos Aires, Argentina. Contenidos de la Dirección General de Escuelas
Física de 4to año
domingo, 19 de agosto de 2012
Los cambios físicos y químicos
Los cambios físicos y químicos
Reacciones químicas
Combustión: es una reacción química de oxidación, en la cual generalmente se desprende una gran cantidad de energía, en forma de calor y luz, manifestándose visualmente como fuego.
En toda combustión existe un elemento que arde (combustible) y otro que produce la combustión (comburente), generalmente oxígeno en forma de O2 gaseoso. Los explosivos tienen oxígeno ligado químicamente por lo que no necesitan el oxígeno del aire para realizar la combustión.
Los tipos más frecuentes de combustible son los materiales orgánicos que contienen carbono e hidrógeno. En una reacción completa todos los elementos tienen el mayor estado de oxidación. Los productos que se forman son el dióxido de carbono (CO2) y el agua, el dióxido de azufre (SO2) (si el combustible contiene azufre) y pueden aparecer óxidos de nitrógeno (NOx), dependiendo de la temperatura y la cantidad de oxígeno en la reacción.
En la combustión incompleta los productos que se queman pueden no reaccionar con el mayor estado de oxidación, debido a que el comburente y el combustible no están en la proporción adecuada, dando como resultado compuestos como el monóxido de carbono (CO). Además, pueden generarse cenizas.
El proceso de destruir materiales por combustión se conoce como incineración.
Para iniciar la combustión de cualquier combustible, es necesario alcanzar una temperatura mínima, llamada temperatura de ignición, que se define como, a la temperatura mínima necesaria para que los vapores generados por un combustible comiencen a arder o hervir depende de su temperatura y se parece a una sustancia pura, o combinada y eso lo convierte en un cambio químico – físico, se mide en °C.
La temperatura de inflamación, en °C y a 1 atm es aquella temperatura a la que un combustible emite gases inflamables suficientes para alcanzar en su atmósfera el límite inferior de inflamabilidad, a partir del cual, con una fuente de calor externa puede producirse una combustión no auto mantenida. a la que, una vez encendidos los vapores del combustible, éstos continúan por si mismos el proceso de combustión.
Biomasa es el término utilizado para describir la materia orgánica no fosilizada en un proceso biológico espontaneo o provocado, utilizado como fuente de energía aunque puede tener uso industriales.
—La biomasa contiene carbono, nitrógeno, oxigeno e hidrogeno como cada ser vivo, y por lo tanto presentara el potencial para la combustión. Esta combustión entonces ofrecerá la energía en forma de calor y electricidad.
La energía generada a partir de la biomasa es una de las formas más prometedoras de reducir, en cantidades importantes, el dióxido de Carbono, proveniente de la combustión del carbón y el gas natural.
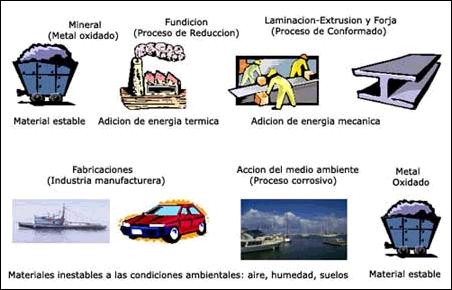
Corrosión: es una reacción química (oxido reducción) en la que intervienen 3 factores: la pieza manufacturada, el ambiente y el agua, o por medio de una reacción electroquímica.
Los factores más conocidos son las alteraciones químicas de los metales a causa del aire, como la herrumbre del hierro y el acero (es una aleación de hierro con una cantidad de carbono variable) o la formación de pátina verde en el cobre y sus aleaciones; de cobre y estaño (bronce) y de cobre y zinc (latón).
Sin embargo, la corrosión es un fenómeno mucho más amplio que afecta a todos los materiales (metales, cerámicas, polímeros, etc.) y todos los ambientes (medios acuosos, atmósfera, alta temperatura, etc.).
Es un problema industrial importante, pues puede causar accidentes (ruptura de una pieza) y, además, representa un costo importante, ya que se calcula que cada pocos segundos se disuelven 5 toneladas de acero en el mundo.
La reacción de síntesis o reacción de combinación es aquella en que dos elementos o compuestos reaccionan para generar un solo producto.
Algunas reacciones de síntesis se dan al combinar un óxido básico con agua, para formar un hidróxido, o al combinar el óxido de un no metal con agua para producir un oxido ácido.
La descomposición química es un proceso que experimentan algunos compuestos químicos en el que, de modo espontáneo o provocado por algún agente externo, a partir de una sustancia compuesta se originan dos o más sustancias de estructura química más simple. Es el proceso opuesto a la síntesis química.
La descomposición química es, con frecuencia, una reacción química no deseada, pues la estabilidad de un compuesto es siempre limitada cuando se le expone a condiciones ambientales extremas como el calor, la electricidad, las radiaciones, la humedad o ciertos compuestos químicos (ácidos, oxidantes, etc). Los casos más frecuentes de descomposición son la descomposición térmica y la electrólisis. La descomposición química total de un compuesto origina los elementos que lo constituyen.
Ecuaciones químicas
Una reacción ácido-base es una reacción química que ocurre entre un ácido que es cualquier compuesto químico que, cuando se disuelve en agua, produce una solución con cationes y una base que es cualquier sustancia que en disolución acuosa aporta iones OH− al medio.
La lluvia ácida se forma cuando la humedad en el aire se combina con los óxidos de nitrógeno y el dióxido de azufre emitidos por fábricas, centrales eléctricas y vehículos que queman carbón o productos derivados del petróleo. En interacción con el vapor de agua, estos gases forman ácido sulfúrico y ácidos nítricos, finalmente, estas sustancias químicas caen a la tierra acompañando a las precipitaciones.
Los contaminantes atmosféricos primarios que dan origen a la lluvia ácida pueden recorrer grandes distancias, siendo trasladados por los vientos cientos o miles de kilómetros antes de precipitar en forma de rocío, lluvia, llovizna, granizo, nieve, niebla o neblina. Cuando la precipitación se produce, puede provocar importantes deterioros en el ambiente.
La lluvia normalmente presenta un pH de aproximadamente 5.65 (ligeramente ácido), debido a la presencia del CO2 atmosférico, que forma ácido carbónico, H2CO3. Se considera lluvia ácida si presenta un pH de menos de 5 y puede alcanzar el pH del vinagre (pH 3). Estos valores de pH se alcanzan por la presencia de ácidos como el ácido sulfúrico, H2SO4, y el ácido nítrico, HNO3. Estos ácidos se forman a partir del dióxido de azufre, SO2, y el monóxido de nitrógeno que se convierten en ácidos.
Un precipitado es el sólido que se produce en una disolución por efecto de difusión o de una reacción química o bioquímica. A este proceso se le llama reacciones de precipitación. Dicha reacción puede ocurrir cuando una sustancia insoluble se forma en la disolución debido a una reacción química o a que la disolución ha sido sobresaturada por algún compuesto, esto es, que no acepta más soluto y que al no poder ser disuelto, dicho soluto forma el precipitado.
En la mayoría de los casos, el precipitado (el sólido formado) cae al fondo de la disolución, aunque esto depende de la densidad del precipitado: si el precipitado es más denso que el resto de la disolución, cae. Si es menos denso, flota, y si tiene una densidad similar, se queda en suspensión.
El efecto de la precipitación es muy útil en muchas aplicaciones, tanto industriales como científicas, en las que una reacción química produce sólidos que después puedan ser recogidos por diversos métodos, como la filtración, la decantación o por un proceso de centrifugado.
Reacciones de Óxido-reducción o REDOX: Se denomina reacción de reducción-oxidación, de óxido-reducción o, simplemente, reacción REDOX, a toda reacción química en la que uno o más pares de electrones se transfieren entre los reactivos, provocando un cambio en sus estados de oxidación.
Para que exista una reacción de reducción-oxidación, en el sistema debe haber un elemento que ceda electrones, y otro que los acepte:
El agente reductor es aquel elemento químico que suministra electrones de su estructura química al medio, aumentando su estado de oxidación, es decir, siendo oxidado.
El agente oxidante es el elemento químico que tiende a captar esos electrones, quedando con un estado de oxidación inferior al que tenía, es decir, siendo reducido.
Cuando un elemento químico reductor cede electrones al medio, se convierte en un elemento oxidado, y la relación que guarda con su precursor queda establecida mediante lo que se llama un «par redox». Análogamente, se dice que, cuando un elemento químico capta electrones del medio, este se convierte en un elemento reducido, e igualmente forma un par redox con su precursor oxidado.
Se llama energía de una reacción química a la energía absorbida o desprendida en la misma por el sistema reactivo.
El valor de la energía de reacción depende de las condiciones de presión y temperatura y de la cantidad de sustancia que se transforma. Los valores de la energía de reacción se expresan por mol de producto formado o reactivo gastado y, generalmente, en condiciones normales: 1 atm y 298 K (25 °C). Se conoce como calor de reacción, ya que se manifiesta de esta forma.
En las reacciones endotérmicas, los productos tienen mayor energía que los reactivos; por ello, debemos comunicar energía a la reacción. La reacción solo tendrá lugar mientras se le suministre dicha cantidad de energía; en el momento en el que no absorba tal cantidad de energía, la reacción se detendrá.
En las reacciones exotérmicas, los productos tienen menos energía que los reactivos, por lo que se desprende energía.
lunes, 2 de julio de 2012
domingo, 1 de julio de 2012
Principio de Arquímedes
El principio de Arquímedes
¿Cómo lo hacen los submarinos y los peces para permanecer quietos a cierta profundidad, sumergirse y emerger? ¿Por qué para los pájaros esto es imposible sin aletear? ¿Cómo funcionan los chalecos salvavidas? ¿Por qué flotan los témpanos de hielo? ¿Por qué las burbujas de aire en el agua, o de gas en las bebidas, siempre ascienden?
Si colocamos sobre agua (figura 65) distintos objetos: madera, plástico, papel, clavos, cubos de hielo, un barquito de papel, etc., veremos que algunos flotan y otros se hunden. Pero esto no depende únicamente del material, también depende de la forma que este tenga. Si con un mismo trozo de plasticina construyes una bola y un disco ahuecado, verás que el primero se hunde mientras que el segundo flota, según se ilustra en la figura 66. Por la misma razón un clavo de hierro se hunde y un barco, del mismo material, flota. Todas estas preguntas y los hechos señalados encuentran su explicación en el principio de Arquímedes. Para saber más sobre Arquímedes lee el recuadro de la figura 67.


Este célebre principio se puede formular del siguiente modo: Sobre un cuerpo sumergido en un líquido actúa una fuerza, de abajo hacia arriba (el empuje), que es igual al peso del líquido desalojado.
El análisis de la figura 68 te ayudará a entender esto. Al sumergir la piedra el nivel del líquido sube, poniendo en evidencia el líquido desalojado por la piedra. Al mismo tiempo, es claro que los volúmenes de la piedra y el líquido desalojado son iguales. Ahora bien, el peso de este líquido, es decir, su masa multiplicada por la aceleración de gravedad, es igual a la magnitud de la fuerza que actúa sobre la piedra, de sentido opuesto al peso y que, por lo tanto, la haría sentir más liviana.

Nadie sabe cómo Arquímedes llegó a esta conclusión, pero se conoce bien la leyenda según la cual el rey Herón de Siracusa encargó al genio averiguar si la corona de oro que le había hecho un orfebre, contenía todo el oro que le habían entregado para su fabricación. Según se dice, hizo el descubrimiento cuando se estaba bañando, y tan contento se puso que salió desnudo y con la corona en sus manos gritando por las calles de su ciudad “¡Eureka! ¡Eureka!...”, en señal de que había hallado la solución al problema.
Ahora bien, lo interesante es comprender que el principio de Arquímedes es una consecuencia de la presión hidrostática. Para entender este punto sigamos el siguiente análisis ayudados por la figura 69. Allí se muestra un líquido de densidad D y sumergido en él un cuerpo cilíndrico de altura H y área A en su parte superior e inferior. Según [3], en la superficie superior la presión es P1 = Dgh1, donde h1 es la profundidad a que se encuentra dicha superficie. Igualmente, en la superficie inferior es P2 = Dgh2. Arriba la fuerza producida por la presión actúa hacia abajo y la de abajo actúa hacia arriba, siendo mayor esta última dado que h2 > h1.

Los valores de estas dos fuerzas deben ser F1 = P1A y F2 = P2A, respectivamente, con lo cual la fuerza total resultante a la presión que aplica el fluido, ya que las fuerzas laterales se anulan, es:
F = F2 – F1;
es decir,
F = (P2 – P1)A,
o bien,
F = (Dgh2 – Dgh1)A;
lo que se puede escribir como:
F = Dg(h2 – h1)A = DgHA;
Pero como el volumen del cilindro, y también el del líquido desalojado, es V = HA, encontramos que la fuerza que actúa hacia arriba y corresponde al empuje E es:
E = DgV [6]
Como la masa del líquido desalojado es, según [1],
m = DV,
el empuje corresponde a
E = mg,
que es el peso del líquido desalojado. Así, hemos demostrado, gracias a las matemáticas, el principio de Arquímedes.
No es muy difícil comprender que este es un resultado general; es decir, no depende de la forma del cuerpo que esté sumergido.
Empuje y peso aparente
Todos hemos experimentado la sensación de sentirnos más livianos cuando estamos sumergidos en agua. Ello no se debe a una reducción de nuestro peso, sino a la presencia del empuje.
Si haces el experimento que se ilustra en la figura 70, podrás constatar que en apariencia el peso de una piedra se reduce al sumergirla en agua. Por ejemplo, si al colgar la piedra del dinamómetro este indica que el peso de la piedra es de 10 newton (a) y al sumergirla en agua (b) indica 8 newton, ello se debe a que sobre la piedra, además de la fuerza de gravedad, está actuando el empuje que ejerce el agua. El peso de la piedra es 10 newton, su peso aparente 8 newton y el empuje 2 newton.

Debes notar que, si consideramos que la densidad del agua es 1.000 kg/m3 y la aceleración de gravedad 10 m/s2, entonces, con la ecuación [6] podemos determinar el volumen de líquido desalojado y el de la piedra (que es el mismo). En efecto,
por lo tanto:
También es importante notar que si conociéramos el volumen de la piedra, la medición del empuje con esta metodología y la expresión [6] nos permitirían determinar la densidad D del líquido en que la hemos sumergido. Este es el principio del densímetro.
Empuje y flotabilidad
Sabemos que algunos objetos flotan sobre los líquidos y otros se hunden. Más exactamente, como lo indica la figura 71, hay tres posibilidades. Si el peso del objeto es mayor que el empuje (a), este se hunde hasta llegar al fondo del recipiente; si es igual al empuje (b), permanecerá “entre dos aguas”; y si es menor que el empuje (c), el cuerpo saldrá a flote y emergerá del líquido reduciéndose el empuje hasta hacerse igual al peso.

En la figura 72 se ilustra este último caso con más detalle. En (a) el cuerpo está completamente sumergido, pero como el empuje es mayor que su peso, está ascendiendo. Luego llegará a la posición que se indica en (b), pero igual que antes, seguirá ascendiendo. Desde este momento en adelante parte del cuerpo quedará por encima del nivel del líquido y el empuje se empezará a reducir, hasta hacerse igual a su peso. En este momento el cuerpo flotará en equilibrio. Las flechas azules indican el sentido del movimiento del cuerpo. En los líquidos en general, en tanto, las burbujas de aire u otros gases ascienden igual que un corcho, y lo hacen por la misma razón.

Problema:
En la figura 73 se ilustra un trozo de madera que flota en equilibrio sobre el agua. ¿Qué parte de él sobresale del agua?

Solución:
Si consideramos [1] tenemos que la masa del trozo de madera es: M = DV. Como la densidad de la madera es 0,42 g/cm3, tomando en cuenta las medidas dadas en la figura 73, tenemos que:
M = 0,42 g/cm3 · 10 cm · 10 cm · 8 cm
M = 336 g
Por lo tanto su peso es
Fg = mg = 0,336 kg · 10 m/s2 = 3,36 newton.
Esta fuerza debe ser igual al empuje que ejerce el agua, dado que la madera está en equilibrio. Luego, considerando [6] podemos escribir:
3,36 newton = 1.000 kg/m3 · 10 m/s2 · 0,10 cm · 0,10 cm · y
de donde
y = 0,0336 m = 3,33 cm;
por lo tanto, como x + y = 8 cm, tenemos que
x = 4,64 cm.
Es importante advertir que el empuje no solamente actúa sobre cuerpos sumergidos en líquidos. En efecto, también actúa sobre los cuerpos sumergidos en la atmósfera. Por ejemplo, un globo lleno de helio, como el que sostiene la persona de la figura 74, asciende porque el empuje que el aire le aplica es mayor que su peso, siendo lo mismo lo que ocurre con los globos aerostáticos. Pero, por extraño que parezca, también actúa sobre las personas y todas las cosas que nos rodean. En otras palabras, cuando nos subimos a una pesa, ella marca un poco menos de lo que marcaría si la atmósfera no existiera. Por esta razón el procedimiento indicado en la figura 46 para determinar el “peso” del aire es incorrecto.

Hagamos una estimación del empuje que el aire le aplica a una persona. Si ella posee una masa de 60 kg y suponiendo que su densidad es igual a la del agua, tendremos que su volumen, considerando [1], es de 0,06 m3. Si la densidad del aire la consideramos igual a 1,29 kg/m3, entonces, según [6], el empuje que él ejerce sobre esta persona es del orden de 0,77 newton, que se puede despreciar si se lo compara con los 600 newton de su peso.
Ahora te mostraremos un juego entretenido. Introduce un gotario a medio llenar con agua en una botella plástica casi llena de agua, según se ilustra en la figura 75, y de modo que flote. Al cerrar la botella y presionar con los dedos sus paredes, podrás constatar que el gotario desciende y, al dejar de presionar la botella, asciende. Este juguete, conocido como ludión o diablillo de Descartes (pues a él se le atribuye su invención), se explica en base al principio de Arquímedes. ¿Cuál es esa explicación?

Para que este juguete funcione como lo hemos descrito y sea sensible a la débil presión que con las manos ejerzamos sobre los costados de la botella, es preciso ajustar el agua dentro del gotario de modo que, cuando flote sobre el agua, esté casi a punto de hundirse en ella.
La capilaridad y la tensión superficial
Al introducir diferentes objetos en agua u otros líquidos, observarás que las zonas en que dichos objetos están en contacto con la superficie de tales líquidos adoptan curvaturas especiales, que llamaremos meniscos. Si el objeto es un tubo capilar, inferior a unos 4 mm de diámetro interior, observarás que el nivel que alcanza el líquido dentro y fuera del tubo es diferente. También podrás constatar que algunos líquidos mojan de manera diferente los objetos; pero en algunos casos los líquidos no mojan en lo absoluto a los objetos, como es el caso del mercurio y el vidrio. En la figura 76 se ilustran los distintos efectos señalados hasta aquí.

Si bien estos efectos son pequeños y en la vida diaria suelen pasar desapercibidos, son de gran importancia y en muchos casos resultan de gran utilidad práctica. Estos fenómenos ocurren debido a que las moléculas de los distintos materiales interactúan eléctricamente con las moléculas de los líquidos y fluidos en general. Cuando el líquido moja al objeto, estas fuerzas son atractivas, y cuando no los mojan, repulsivas. Por otra parte, en las superficies de los líquidos estos átomos y moléculas se atraen entre sí más fuertemente que en otros lugares, produciendo lo que se denomina tensión superficial. El que los líquidos puedan ascender por delgados tubos se denominacapilaridad.
A continuación señalaremos distintas situaciones corrientes en que tales fenómenos tienen lugar. Es importante que realices las observaciones y experimentos que se proponen y te convenzas por ti mismo de lo que aquí se dice. Si calientas en un mechero un tubo capilar de vidrio y lo estiras cuando se esté fundiendo de modo que se adelgace lo más posible, observarás que al introducir un extremo en agua esta asciende varios centímetros por el tubo, como se indica en la figura 77. Prueba con capilares de diferentes diámetros; el efecto puede llegar a ser sorprendente. Si agregas al agua una gota de tinta china, posiblemente verás que el colorante no asciende por el tubo. ¿Por qué ocurrirá esto?

Hay papeles más absorbentes que otros. La publicidad de servilletas y toallas de papel suelen destacar esta propiedad. La figura 78 muestra el diseño de un experimento que permite evaluar este aspecto. Corta tiras de igual ancho pero de distintos papeles y cartones e introduce sus extremos en agua. Después de un rato verás que el agua asciende más en unos que en otros. ¿Qué fenómeno es el que está ocurriendo aquí? ¿Qué tienen los papeles que permiten que esto ocurra?

Con un alambre muy delgado construye un resorte cuyas espiras posean unos 2 cm de diámetro y midan unos 10 cm de largo cuando entre las espiras haya alrededor de 5 mm de distancia. En su extremo conforma una argolla lo más plana posible. Lo que has construido es un dinamómetro de gran sensibilidad, útil para poner en evidencia la tensión superficial en líquidos. Si introduces la argolla en agua, como se indica en la figura 79, constatarás que al levantar el resorte este se estira. Compara la tensión superficial que producen diferentes líquidos: aceite, mercurio, alcohol, etc.
Si eres muy cuidadoso y paciente, posiblemente serás capaz de poner una aguja de cocer sobre el agua sin que se hunda (figura 79). Si no tienes tanta paciencia, puedes lograrlo pasando primero la aguja por una vela (parafina sólida). ¿Qué efecto producirá la espira?
Si eres muy cuidadoso y paciente, posiblemente serás capaz de poner una aguja de cocer sobre el agua sin que se hunda (figura 79). Si no tienes tanta paciencia, puedes lograrlo pasando primero la aguja por una vela (parafina sólida). ¿Qué efecto producirá la espira?

Posiblemente has visto que algunos insectos pueden caminar sobre el agua, ¿cómo lo lograrán? Dato curioso: si una piscina estuviera llena de mercurio en vez de agua, podrías caminar por su superficie al igual que algunos insectos en el agua.
Si disuelves un poco de jabón en agua e introduces en ella una argolla, al sacarla podrás ver una delgada película de líquido que se sostiene en los bordes de la argolla. Si soplas suavemente podrás formar hermosas burbujas que vuelan por el aire hasta reventar en el momento de tocar un objeto. Al agitar la superficie del agua jabonosa también podrás ver que en ella se forman numerosas burbujas. ¿Cómo explicas la formación de las burbujas?
Otra observación interesante que tiene relación con los hechos descritos son las gotas en diferentes líquidos; ¿serán todas las gotas de agua del mismo tamaño? ¿Qué pasa con gotas de agua, alcohol, aceite y mercurio si se colocan sobre la superficie horizontal de un vidrio? ¿Qué diferencia tiene una gota de agua, colocada sobre un vidrio horizontal, comparada con la que se forma en una superficie de teflón? ¿Por qué los gásfiter emplean huinchas de teflón en las uniones de las cañerías de agua?
La capilaridad es aprovechada por el reino animal y vegetal, siendo de gran importancia para la vida. Por ejemplo, en todos los organismos hay una red capilar que lleva los nutrientes a los tejidos y los órganos, a través de la linfa en los vegetales, y de la sangre en los animales. La capilaridad contribuye significativamente a que la linfa llegue a más de 120 metros de altura en los grandes árboles. Si te interesa la biología puede resultar muy interesante que realices una investigación bibliográfica acerca de estos aspectos.
viernes, 29 de junio de 2012
Separación de componentes de una solución
Los Métodos de Separación se basan en diferencias entre las propiedades físicas de los componentes de una mezcla, tales como: Punto de Ebullición, Densidad, Presión de Vapor, Punto de Fusión, Solubilidad, etc.

Destilación
Este método consiste en separar los componentes de las mezclas basándose en las diferencias en los puntos de ebullición de dichos componentes. Cabe mencionar que un compuesto de punto de ebullición bajo se considera "volátil" en relación con los otros componentes de puntos de ebullición mayor. Los compuestos con una presión de vapor baja tendrán puntos de ebullición altos y los que tengan una presión de vapor alta tendrán puntos de ebullición bajos.
En muchos casos al tratar de separar un componente de la mezcla por destilación en la fase gas se forma una especie de asociación entre las moléculas llamada azeótropo el cual puede presentar un cambio en el punto de ebullición al realizar la destilación.
Los tipos de Destilación más comunes son: La Destilación Simple, Destilación Fraccionada y la Destilación por Arrastre con Vapor. En la Destilación Simple, el proceso se lleva a cabo por medio de una sola etapa, es decir, que se evapora el líquido de punto de ebullición más bajo (mayor presión de vapor) y se condensa por medio de un refrigerante
En la Destilación fraccionada el proceso se realiza en multi-etapas por medio de una columna de destilación en la cual, se llevan a cabo continuamente numerosas evaporaciones y condensaciones. Al ir avanzando a lo largo de la columna, la composición del vapor es más concentrada en el componente más volátil y la concentración del líquido que condensa es más rica en el componente menos volátil. Cabe mencionar que este tipo de destilación es mucho más eficiente que una destilación simple y que mientras más etapas involucre, mejor separación se obtiene de los componentes
En la Destilación por Arrastre con Vapor se hace pasar una corriente de vapor a través de la mezcla de reacción y los componentes que son solubles en el vapor son separados. Entre las sustancias que se pueden separar por esta técnica se pueden citar los Aceites Esenciales.
Evaporación
El procedimiento de Evaporación consiste en separar los componentes mas volátiles exponiendo una gran superficie de la mezcla al calor y a una corriente de aire seco que acelera el proceso.

Cristalización
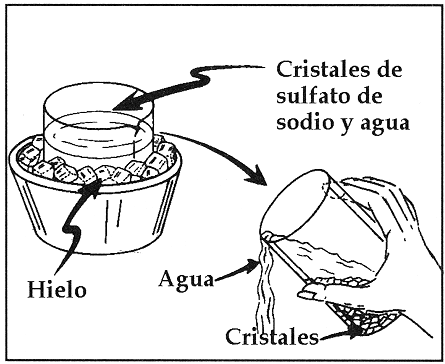
Para efectuar la Cristalización de un Sólido hay que partir de una Solución Sobre-Saturada. Existen varias formas de Sobre-Saturar una Solución, una de ellas es el enfriamiento de la solución, otra consiste en eliminar parte del Disolvente (Por ejemplo: por evaporación) a fin de aumentar la concentración del soluto, otra forma consiste en añadir un tercer componente que tenga una mayor solubilidad que el componente que se desea cristalizar.
La rapidez del Enfriamiento definirá el tamaño de los cristales resultantes. Un enfriamiento rápido producirá cristales pequeños, mientras que un enfriamiento lento producirá cristales grandes. Para acelerar la Cristalización puede hacerse una "siembra" raspando las paredes del recipiente.
La Solubilidad.
Es una medida de la capacidad de disolverse una determinada sustancia (soluto) en un determinado medio (solvente); implícitamente se corresponde con la máxima cantidad de soluto disuelto en una dada cantidad de solvente a una temperatura fija y en dicho caso se establece que la solución está saturada. Su concentración puede expresarse en moles por litro, en gramos por litro, o también en porcentaje de soluto (m(g)/100 ml) . El método preferido para hacer que el soluto se disuelva en esta clase de soluciones es calentar la muestra y enfriar hasta temperatura ambiente (normalmente 25°C). En algunas condiciones la solubilidad se puede sobrepasar de ese máximo y pasan a ser soluciones sobresaturadas.
No todas las sustancias se disuelven en un mismo solvente. Por ejemplo, en el agua, se disuelve el alcohol y la sal, en tanto que el aceite y la gasolina no se disuelven.
El término solubilidad se utiliza tanto para designar al fenómeno cualitativo del proceso de disolución como para expresar cuantitativamente la concentración de las soluciones. La solubilidad de una sustancia depende de la naturaleza del disolvente y del soluto, así como de la temperatura y la presión del sistema.
Fases y componentes
Fase de un sistema material es una porción de materia que posee idénticas propiedades, tanto físicas como químicas, en toda su extensión.
Los componentes de un sistema material son las sustancias que componen dichos sistemas.
Sistemas homogéneos Las propiedades intensivas son iguales en todas sus partes. Cualquier fracción de ella que se considere tiene el mismo punto de fusión, densidad, índice de refracción, etcétera. Están constituidos por una sola fase, aunque pueden estar formadas por una o más sustancias (componentes). Ejemplos: agua destilada, azúcar, aceite, sal de mesa, agua de mar filtrada, nafta, etcétera.
Sistemas heterogéneos Las propiedades intensivas son diferentes según la porción que se examine. Están formados por lo menos por dos fases. La superficie de separación entre las fases (interfase) es evidente y bien definida. Ej: agua y aceite, hielo y agua Cada fase, si es separada de las demás, forma un sistema homogéneo.

Soluciones: Saturadas; no saturadas; sobresaturadas
Una Solución consta de dos componentes: El Disolvente y el Soluto. Las Soluciones pueden ser No-Saturadas, Saturadas y Sobre-Saturadas
Las Soluciones No-Saturadas tienen una concentracion de soluto menor que las soluciones saturadas, y éstas a su vez tienen una concentración de solucto menor que una solución sobresaturada. Por ejemplo: Supóngase que se agregan unos cuantos cristales de Sal Común a un Vaso de Agua. Esta será una Solución No-Saturada. Si se sigue añadiendo Sal con agitación se llegará hasta un punto en el cual los cristales ya no se disuelven. Esta será una Solución Sobre-Saturada. Si esta solución se deja reposar y se remueven los cristales que no se disolvieron, se obtendrá una Solución Saturada que contendrá la cantidad máxima de soluto que se puede disolver a la temperatura actual que llamaremos inicial.
Si enfriamos la solución Saturada, con el tiempo se formarán cristales de Sal, ésto se debe a que la solubilidad de la Sal en el Agua depende de la Temperatura y lo que fue una solución saturada a la temperatura inicial es ahora una solución sobre-saturada a la temperatura final. Es importante recalcar que una solución sobresaturada es un sistema metaestable y que tenderá a estabilizarse, mientras que una solución saturada es un sistema estable.

domingo, 24 de junio de 2012
Magnetismo y aplicaciones
Imanes naturales
La magnetita es un imán natural que, como el resto de los imanes, posee una serie de propiedades. Pulsa sobre cada botón para conocer las propiedades de los imanes:
1.- Magnetismo
| Existe en la naturaleza un mineral llamado magnetita o piedra imán que tiene la propiedad de atraer el hierro, el cobalto, el níquel y ciertas aleaciones de estos metales. Esta propiedad recibe el nombre de magnetismo. | ||
| Los imanes:Un imán es un material capaz de producir un campo magnético exterior y atraer el hierro (también puede atraer al cobalto y al níquel). Los imanes que manifiestan sus propiedades de forma permanente pueden ser naturales, como la magnetita (Fe3O4) o artificiales, obtenidos a partir de aleaciones de diferentes metales. Podemos decir que un imánpermanente es aquel que conserva el magnetismo después de haber sido imantado. Un imántemporal no conserva su magnetismo tras haber sido imantado.
Polos magnéticos
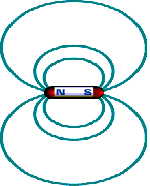
En un imán la capacidad de atracción es mayor en sus extremos o polos. Estos polos se denominan norte y sur, debido a que tienden a orientarse según los polos geográficos de la Tierra, que es un gigantesco imán natural. Líneas de campo magnético
|  | |
| Desde hace tiempo es conocido que una corriente eléctrica genera un campo magnético a su alrededor. En el interior de la materia existen pequeñas corrientes cerradas debidas al movimiento de los electrones que contienen los átomos, cada una de ellas origina un microscópico imán o dipolo. Cuando estos pequeños imanes están orientados en todas direcciones sus efectos se anulan mutuamente y el material no presenta propiedades magnéticas; en cambio si todos los imanes se alinean actúan como un único imán y en ese caso decimos que la sustancia se ha magnetizado.
Magnetismo inducido
Imantar un material es ordenar sus imanes atómicos. En la figura derecha se observa en primer lugar un material sin imantar y debajo un material imantado. | 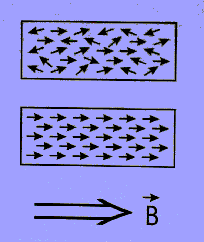 | |
El magnetismo es producido por imanes naturales o artificiales. Además de su capacidad de atraer metales, tienen la propiedad de polaridad. Los imanes tienen dos polos magnéticos diferentes llamados Norte o Sur. Si enfrentamos los polos Sur de dos imanes estos se repelen, y si enfrentamos el polo sur de uno, con el polo norte de otro se atraen. Otra particularidad es que si los imanes se parten por la mitad, cada una de las partes tendrá los dos polos.
Cuando se pasa una piedra imán por un pedazo de hierro, éste adquiere a su vez la capacidad de atraer otros pedazos de hierro.
La atracción o repulsión entre dos polos magnéticos disminuye a medida que aumenta el cuadrado de la distancia entre ellos.
| ||
| Campo magnético:Se denomina campo magnético a la región del espacio en la que se manifiesta la acción de un imán. Un campo magnético se representa mediante líneas de campo. | ||
| Un imán atrae pequeños trozos de limadura de hierro, níquel y cobalto, o sustancias compuestas a partir de estos metales (ferromagnéticos).La imantación se transmite a distancia y por contacto directo. La región del espacio que rodea a un imán y en la que se manifiesta las fuerzas magnéticas se llama campo magnético. Las líneas del campo magnético revelan la forma del campo. Las líneas de campo magnético emergen de un polo, rodean el imán y penetran por el otro polo. Fuera del imán, el campo esta dirigido del polo norte al polo sur. La intensidad del campo es mayor donde están mas juntas las líneas (la intensidad es máxima en los polos). 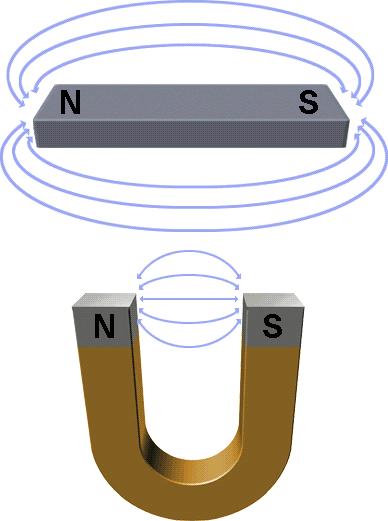 El campo eléctrico es una consecuencia relativista del campo magnético. El movimiento de la carga produce un campo magnético. En un imán de barra común, que al parecer esta inmóvil, esta compuesto de átomos cuyos electrones se encuentran en movimiento (girando sobre su orbita. Esta carga en movimiento constituye una minúscula corriente que produce un campo magnético. Todos los electrones en rotación son imanes diminutos.
UNA CARGA EN MOVIMIENTO PRODUCE UN CAMPO MAGNÉTICO
Brújula
La brújula señala al norte magnético de la tierra, que no coincide con el norte geográfico, como había explicado antes los polos opuestos se atraen y los iguales se repelen, en el norte geográfico de la tierra se encuentra el polo sur magnéticamente hablando por lo que su opuesto (el norte en este caso) apunta lo contrario en una brújula 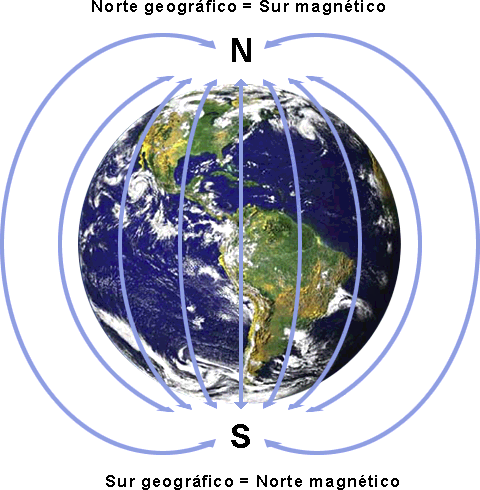
La tierra es un imán. Campo magnético terrestre.
Navegación
Polos geográficos y magnéticos. Campo terrestre
La función de un electroimán, es justamente, lo que señala su nombre. Un electroimán, es un imán, que funciona como tal en la medida que pase corriente por su bobina. Dejan de magnetizar, al momento en que se corta la corriente. Un electroimán, es compuesto en su interior, por un núcleo de hierro. Núcleo al cual, se le ha incorporado un hilo conductor, recubierto de material aislante, tal como la seda o el barniz. Hilo que tiene que ir enrollado en el núcleo, para que el electroimán funcione. Otra manera de hacer funcionar un electroimán, es de la manera contraria. Cesando el paso de la corriente, por su núcleo. Esto sucede, cuando un electroimán, cuenta con un núcleo de acero. Con lo cual, queda funcionando al igual, que un imán corriente.  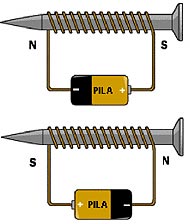 | ||
Motores eléctricos: es una máquina eléctrica que transforma energía eléctrica en energía mecánica por medio de interacciones electromagnéticas. Algunos de los motores eléctricos son reversibles, es decir, pueden transformar energía mecánica en energía eléctrica funcionando como generadores.


CALOR Y
TEMPERATURA
El cuerpo humano: su calor y su temperatura
Las experiencias
sobre calor y temperatura más próxima a nosotros son aquellas que tienen lugar
en nuestro propio cuerpo.
Todos sabemos
que el organismo humano debe mantener su temperatura constante en torno a los 37ºC , para que de esta forma
nuestros órganos puedan funcionar con normalidad. De hecho, casi el 80% de la
energía que obtenemos de los alimentos que consumimos y del oxígeno que
respiramos se invierte en mantener constante esa temperatura y solo el 20%
restante se emplea en realizar las diversas actividades que ejercemos.
Cuando en los
días fríos, disminuye la temperatura de los miembros más periféricos de nuestro
cuerpo (las extremidades), nuestros centros vitales (corazón, pulmones,
cerebro, etc.) siguen manteniendo la temperatura inalterable.
Temperatura
En la vida
diaria usamos muy a menudo dos palabras cuyo significado suele confundirse:
calor y temperatura. Aunque íntimamente ligados, son dos conceptos diferentes.
¿Cuál es la diferencia? Para explicarla hagamos la siguiente comparación: si en
un recipiente echamos agua, ésta alcanzará un cierto nivel. Si se echa más
agua, el nivel sube, pero nadie confundirá la cantidad de agua con el nivel del
agua.
Una diferencia
semejante hay entre cantidad de calor y temperatura o “nivel calórico”. Al
calentar agua en un recipiente, se le entrega una cierta cantidad de
calor, y la temperatura, o “nivel” de
calor, sube, como sube el nivel del agua cuando se echa más en el recipiente.
Más todavía; dos cuerpos pueden tener la misma temperatura
y distintas cantidades de calor.

Si hacemos
hervir agua en los dos recipientes como lo muestra la figura anterior, la temperatura alcanzada es la
misma para los dos, 100ºC ,
pero el que tiene más agua tiene mayor cantidad de calor.
También podemos
comprobar esta diferencia con la siguiente experiencia:
Calienta con la
misma hornalla y durante el mismo tiempo dos cantidades diferentes de agua o de
cualquier otra sustancia que inicialmente se encuentren a la misma temperatura.
Al hacerlo se comprobará un aumento de temperatura mayor para la cantidad más
pequeña de agua, que para la cantidad más grande. Es decir que habiendo
recibido la misma cantidad de calor y durante el mismo tiempo hemos obtenido
diferentes variaciones de temperatura.
Cuando se ponen
en contacto dos cuerpos que se encuentran a distintas temperaturas, el calor
pasa del cuerpo que posee más temperatura al cuerpo que posee menos
temperatura, con independencia de la masa y del tamaño de los mismos. Así, si
sumergimos en agua fría un trozo de hierro al rojo vivo, se comprobará que se
produce una transmisión de calor desde el hierro hacia el agua. Esta
transmisión de calor cesa cuando las temperaturas de ambos cuerpos se igualan.
Debemos definir
que existe una forma de energía en las moléculas que depende del “grado de
calor” que posean: a esa energía la llamamos Energía cinética o energía de
movimiento. Cuanto más calor reciban, se van a mover a mayor velocidad, y
cuanta menos energía calórica posean, tendrán menor velocidad. (Esto proviene
de la Teoría
cinética molecular).
Al calor se lo
considera como una energía en tránsito, significa que los cuerpos ceden y ganan
calor pero no lo poseen.
Cuando un cuerpo
recibe calor, aumenta la velocidad con la que se mueven dichas moléculas y este
aumento será tanto mayor cuanto mayor sea la cantidad de calor recibido o menor
sea el número de moléculas que forman ese cuerpo.
La temperatura es una medida de la energía cinética
media de las moléculas que forman un cuerpo.
Termómetro
de mercurio
Se toma un tubo
de sección muy fina (tubo capilar) con una ampolla cerrada, el bulbo, en un
extremo y con una abertura en el otro. Se calientan las dos extremidades y
luego se introduce la extremidad abierta en una cubeta de mercurio. Éste
penetra en el tubo y luego, mediante suaves golpecitos, se los hace llegar
hasta el bulbo. Repitiendo la operación se consigue llenar el bulbo y el tubo.
Se procede luego a cerrar el tubo con una llama, después de haber hecho hervir
el mercurio, para eliminar cualquier partícula de aire.

La
medida de la temperatura
Te resultará
habitual la palabra grado como unidad para medir la temperatura, pero en
realidad esta unidad es sólo una de las unidades que existen para medir esta
magnitud.
La temperatura
puede medirse según tres escalas diferentes:
v
La escala centígrada o
escala Celsius:
v
La escala absoluta o escala
Kelvin
v
La escala anglosajona o
escala Fahrenheit

La escala centígrada o escala Celsius fija un valor de la temperatura igual a cero en el punto de
congelación del agua (0 grados centígrados, 0ºC ) y un valor de la temperatura igual a cien
en el punto de ebullición del agua a la presión atmosférica normal (100 grados
centígrados, 100ºC )
a la presión atmosférica normal: una atmósfera de presión. El intervalo entre
ambas temperaturas se divide en cien partes iguales, cada una de las cuales se
denomina grado centígrado o grado Celsius.
La escala absoluta o escala Kelvin fija un valor de la temperatura igual a cero en la temperatura más
baja que se puede alcanzar, que corresponde al estado en que todas las
moléculas que forman un cuerpo estarían en reposo y que equivale a -273ºC (0 Kelvin, 0 K), no se pone el cero como
supra índice en el grado Kelvin y cada
unidad de esta escala tiene el mismo valor que el de la escala centígrada.
Para obtener en
Kelvin ( K) una temperatura que viene dada en grados centígrados (ºC), se
utiliza esta ecuación:
K= °C+273
La escala
anglosajona o escala Fahrenheit fija un valor de la
temperatura igual a treinta y dos en el punto de fusión del agua (cuando pasa
del estado sólido al liquido) (32 grados Fahrenheit, 32ºF ), y un valor de la
temperatura igual a doscientos doce en el punto de ebullición del agua a la
presión atmosférica normal (212 grados Fahrenheit, 212ºF ). El intervalo entre
ambas temperaturas se divide en 180 partes iguales cada una de las cuales se
denomina grado Fahrenheit.
Para obtener en
grados Fahrenheit (ºF) una temperatura dada en grados centígrados (ºC) se
utiliza esta ecuación:
Suscribirse a:
Entradas (Atom)