Separación de componentes de una solución
Los Métodos de Separación se basan en diferencias entre las propiedades físicas de los componentes de una mezcla, tales como: Punto de Ebullición, Densidad, Presión de Vapor, Punto de Fusión, Solubilidad, etc.

Destilación
Este método consiste en separar los componentes de las mezclas basándose en las diferencias en los puntos de ebullición de dichos componentes. Cabe mencionar que un compuesto de punto de ebullición bajo se considera "volátil" en relación con los otros componentes de puntos de ebullición mayor. Los compuestos con una presión de vapor baja tendrán puntos de ebullición altos y los que tengan una presión de vapor alta tendrán puntos de ebullición bajos.
En muchos casos al tratar de separar un componente de la mezcla por destilación en la fase gas se forma una especie de asociación entre las moléculas llamada azeótropo el cual puede presentar un cambio en el punto de ebullición al realizar la destilación.
Los tipos de Destilación más comunes son: La Destilación Simple, Destilación Fraccionada y la Destilación por Arrastre con Vapor. En la Destilación Simple, el proceso se lleva a cabo por medio de una sola etapa, es decir, que se evapora el líquido de punto de ebullición más bajo (mayor presión de vapor) y se condensa por medio de un refrigerante
En la Destilación fraccionada el proceso se realiza en multi-etapas por medio de una columna de destilación en la cual, se llevan a cabo continuamente numerosas evaporaciones y condensaciones. Al ir avanzando a lo largo de la columna, la composición del vapor es más concentrada en el componente más volátil y la concentración del líquido que condensa es más rica en el componente menos volátil. Cabe mencionar que este tipo de destilación es mucho más eficiente que una destilación simple y que mientras más etapas involucre, mejor separación se obtiene de los componentes
En la Destilación por Arrastre con Vapor se hace pasar una corriente de vapor a través de la mezcla de reacción y los componentes que son solubles en el vapor son separados. Entre las sustancias que se pueden separar por esta técnica se pueden citar los Aceites Esenciales.
Evaporación
El procedimiento de Evaporación consiste en separar los componentes mas volátiles exponiendo una gran superficie de la mezcla al calor y a una corriente de aire seco que acelera el proceso.

Cristalización
Para efectuar la Cristalización de un Sólido hay que partir de una Solución Sobre-Saturada. Existen varias formas de Sobre-Saturar una Solución, una de ellas es el enfriamiento de la solución, otra consiste en eliminar parte del Disolvente (Por ejemplo: por evaporación) a fin de aumentar la concentración del soluto, otra forma consiste en añadir un tercer componente que tenga una mayor solubilidad que el componente que se desea cristalizar.
La rapidez del Enfriamiento definirá el tamaño de los cristales resultantes. Un enfriamiento rápido producirá cristales pequeños, mientras que un enfriamiento lento producirá cristales grandes. Para acelerar la Cristalización puede hacerse una "siembra" raspando las paredes del recipiente.
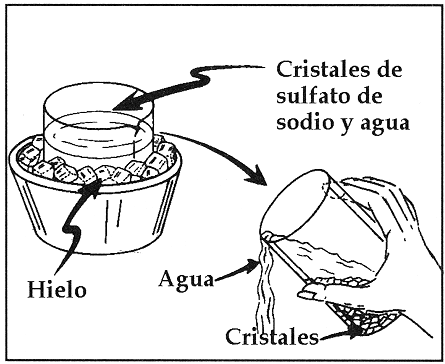
La Solubilidad.
Es una medida de la capacidad de disolverse una determinada sustancia (soluto) en un determinado medio (solvente); implícitamente se corresponde con la máxima cantidad de soluto disuelto en una dada cantidad de solvente a una temperatura fija y en dicho caso se establece que la solución está saturada. Su concentración puede expresarse en moles por litro, en gramos por litro, o también en porcentaje de soluto (m(g)/100 ml) . El método preferido para hacer que el soluto se disuelva en esta clase de soluciones es calentar la muestra y enfriar hasta temperatura ambiente (normalmente 25°C). En algunas condiciones la solubilidad se puede sobrepasar de ese máximo y pasan a ser soluciones sobresaturadas.
No todas las sustancias se disuelven en un mismo solvente. Por ejemplo, en el agua, se disuelve el alcohol y la sal, en tanto que el aceite y la gasolina no se disuelven.
El término solubilidad se utiliza tanto para designar al fenómeno cualitativo del proceso de disolución como para expresar cuantitativamente la concentración de las soluciones. La solubilidad de una sustancia depende de la naturaleza del disolvente y del soluto, así como de la temperatura y la presión del sistema.
Fases y componentes
Fase de un sistema material es una porción de materia que posee idénticas propiedades, tanto físicas como químicas, en toda su extensión.
Los componentes de un sistema material son las sustancias que componen dichos sistemas.
Sistemas homogéneos Las propiedades intensivas son iguales en todas sus partes. Cualquier fracción de ella que se considere tiene el mismo punto de fusión, densidad, índice de refracción, etcétera. Están constituidos por una sola fase, aunque pueden estar formadas por una o más sustancias (componentes). Ejemplos: agua destilada, azúcar, aceite, sal de mesa, agua de mar filtrada, nafta, etcétera.
Sistemas heterogéneos Las propiedades intensivas son diferentes según la porción que se examine. Están formados por lo menos por dos fases. La superficie de separación entre las fases (interfase) es evidente y bien definida. Ej: agua y aceite, hielo y agua Cada fase, si es separada de las demás, forma un sistema homogéneo.

Soluciones: Saturadas; no saturadas; sobresaturadas
Una Solución consta de dos componentes: El Disolvente y el Soluto. Las Soluciones pueden ser No-Saturadas, Saturadas y Sobre-Saturadas
Las Soluciones No-Saturadas tienen una concentracion de soluto menor que las soluciones saturadas, y éstas a su vez tienen una concentración de solucto menor que una solución sobresaturada. Por ejemplo: Supóngase que se agregan unos cuantos cristales de Sal Común a un Vaso de Agua. Esta será una Solución No-Saturada. Si se sigue añadiendo Sal con agitación se llegará hasta un punto en el cual los cristales ya no se disuelven. Esta será una Solución Sobre-Saturada. Si esta solución se deja reposar y se remueven los cristales que no se disolvieron, se obtendrá una Solución Saturada que contendrá la cantidad máxima de soluto que se puede disolver a la temperatura actual que llamaremos inicial.
Si enfriamos la solución Saturada, con el tiempo se formarán cristales de Sal, ésto se debe a que la solubilidad de la Sal en el Agua depende de la Temperatura y lo que fue una solución saturada a la temperatura inicial es ahora una solución sobre-saturada a la temperatura final. Es importante recalcar que una solución sobresaturada es un sistema metaestable y que tenderá a estabilizarse, mientras que una solución saturada es un sistema estable.

No hay comentarios:
Publicar un comentario